检测所送检流程分享;我们是药监局认可的第三方检测实验室,如果你考虑送检药监局检测所周期长,那可以送检我们!
法规依据:
《医疗器械注册管理办法》(CFDA局令第4号)
CFDA关于发布医疗器械产品技术要求编写指导原则的通告(第9号)
CFDA关于印发医疗器械检验机构开展医疗器械产品技术要求预评价工作规定的通知(食药监械管〔2014〕192号)
总局办公厅关于做好医疗器械检验有关工作的通知(食药监办械管〔2017〕187号)
法规要求:
申请人或者备案人应当编制拟注册或者备案医疗器械的产品技术要求。*类医疗器械的产品技术要求由备案人办理备案时提交食品药品监督管理部门。第二类、第三类医疗器械的产品技术要求由食品药品监督管理部门在批准注册时予以核准。
产品技术要求主要包括医疗器械成品的性能指标和检验方法,其中性能指标是指可进行客观判定的成品的功能性、安全性指标以及与质量控制相关的其他指标。
在中国上市的医疗器械应当符合经注册核准或者备案的产品技术要求。
申请第二类、第三类医疗器械注册,应当进行注册检验。医疗器械检验机构应当依据产品技术要求对相关产品进行注册检验。
注册检验样品的生产应当符合医疗器械质量管理体系的相关要求,注册检验合格的方可进行临床试验或者申请注册。
办理*类医疗器械备案的,备案人可以提交产品自检报告。
申请注册检验,申请人应当向检验机构提供注册检验所需要的有关技术资料、注册检验用样品及产品技术要求。
医疗器械检验机构应当具有医疗器械检验资质、在其承检范围内进行检验,并对申请人提交的产品技术要求进行预评价。预评价意见随注册检验报告一同出具给申请人。
尚未列入医疗器械检验机构承检范围的医疗器械,由相应的注册审批部门指定有能力的检验机构进行检验。
第十九条同一注册单元内所检验的产品应当能够代表本注册单元内其他产品的安全性和有效性。
检验流程(中检院例):
一、注册检验
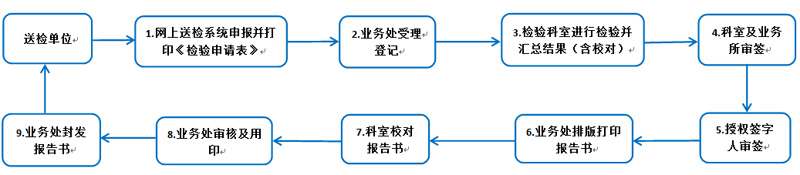
说明:
步骤1:进口注册检验须先到相关业务所综办办理进口质量标准复核通知件。
步骤2:包括业务评审、资料审核、样品登记、送样、留样入库等工作。
步骤3:包括标准复核、方法学验证、实验室检测与复核、报告汇总、校对等工作。
步骤4:包括科室主任审签和主管业务处审签。
步骤5:不合格报告书由分管院领导审签。
步骤6:包括网上电子版和纸质材料的接收登记、打印后通知科室人员校对、校对发现问题重新修改打印等。
二、合同/委托检验
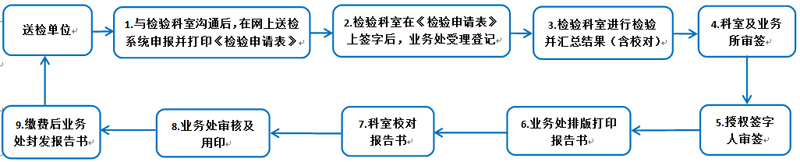
说明:
步骤1:合同检验适用对象为企业;委托检验适用对象为行政司法、药监药检等机构。合同/委托检验须先与检验科室沟通后再按流程办理。
步骤2~步骤6:同注册检验业务流程说明。
步骤9:合同/委托检验须按照我院规定缴费后发送报告。合同检验报告由检验科室发送。
