中国医疗器械注册流程需要多长时间?办医疗器械注册证要多少钱?这是许多客户*向想了解的事宜,今天阐释下:
规划医疗器械在中国的市场准入,在项目启动前计算成本和时间是必不可少的。我们在下表中列出了在NMPA进行产品注册的官方费用以及获得产品批准的平均时间。
产品类别 | 类型 | 官方费用(欧元) | 时间(从准备开始) |
一类 | 初始和变更登记 | 自由 | 1个月 |
二类 | 初次注册 | 26.500 | 16-24个月 |
| 更改注册 | 5.300 | 16-24个月 |
| 延期注册(每5年) | 5.150 | 5个月 |
第三类 | 初次注册 | 38.900 | 24-36个月 |
| 更改注册 | 6.350 | 24-36个月 |
| 延期注册(每5年) | 5.150 | 7个月 |
| 预 | 自由 | 1个月 |
| 产品分类的应用 | 自由 | 3个月 |
| 变更登记 | 自由 | 1个月 |
在图1中,我们概述了NMPA审查过程的时间表。审查过程的时间适用于所有三种类型的产品注册,但管理事项中的变更注册需要35个工作日。Day中显示的所有时间都与图左侧权威站点的工作日有关,除此之外,图右侧合法制造商站点的额外请求准备时间为1年。该技术档案可以通过提交电子监管的产品提交电子RPS电子方式。来自NMPA的所有通知函和来自制造商的额外回复均按照百检网注册中心进行传达。
在提交电子技术档案后的前5个工作日内,NMPA提供带有已知检查清单的验收审查。如果档案完整,将通知合法制造商以完成产品注册付款。如果NMPA向您发送了缺陷信函,则通常意味着在档案完整性方面存在缺陷。

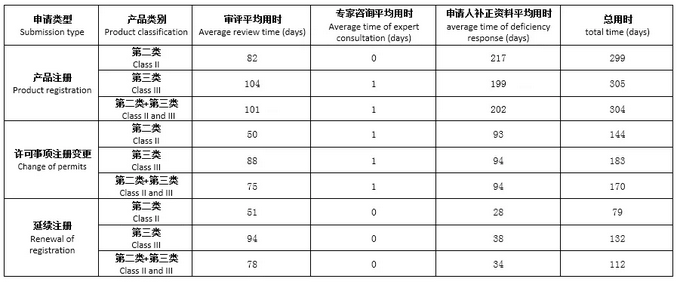
技术评审分为两个阶段,分别为II级MD60个工作日和III级MD90个工作日。在这2次技术审查之间,合法制造商只有一年的时间来提交额外的回复。时钟保持以响应NMPA站点的附加请求。NMPA的II类MD审查时间约为8个月(155个工作日),III类MD的审查时间为9个月(185个工作日)。
第三列对应CMDE2.阶段技术审核后的实际审核时间。第五栏的时间(表中“缺陷响应的平均时间”)为合法制造商现场缺陷信的工作时间。
一般来说,初次登记的审查时间比变更登记(表中的许可变更)要长得多。令人惊讶的是,这两种注册类型的CMDE需要的天数(图2中的第三列)比到期时间(见图1)少。制造商应该准备好更早地收到缺陷信。可以想象,制造商需要很长时间(初始注册需要10个月,变更注册需要4.5个月)来回答缺陷信。真正的总时间II类和III类医疗器械在15个月左右(299天和305天)几乎相同。
当II类,第三类医疗设备在NMPA一旦注册,在医疗器械技术审评时间更新可以相当流畅,在平均4个月左右。
